[Química] – Acompanhamento UFRR/UERR 2025
-
[Química] – Semana 0 – Introdução à química geral3 Aulas|1 Teste
-
[Química] – Semana 01 – Propriedades da matéria, substância, mistura e separação de misturas8 Aulas|2 Testes
-
[Química] – Semana 02 – Atomística – Parte 012 Aulas|1 Teste
-
[QUÍMICA] – Semana 03 – Atomística – Parte 023 Aulas|2 Testes
-
[QUÍMICA] – Semana 04 – Atomística – Parte 03 e Tabela periódica3 Aulas|2 Testes
-
[QUÍMICA] – Semana 05 – Ligações químicas5 Aulas|2 Testes
-
[QUÍMICA] – Semana 06 – Geometria molecular e interações intermoleculares5 Aulas|4 Testes
-
[QUÍMICA] – Semana 07 – Reação de oxirredução e balanceamento6 Aulas|1 Teste
-
[QUÍMICA] – Semana 08 – Funções inorgânicas – Parte 019 Aulas|2 Testes
-
Aula 41 – Óxidos
-
Aula 29 – Introdução às funções inorgânicas
-
Aula 31 – Nomenclatura de ácidos – Ácidos padrões
-
Aula 30 – Ácidos e suas classificações
-
Aula 32 – Nomenclatura de ácidos – Método por Nox
-
Aula 33 – Chuva ácida
-
Aula 34 – Bases de Arrhenius
-
Aula 35 – Nomenclatura de bases
-
Aula 36 – Indicadores ácido-base e escala de pH
-
Aula 41 – Óxidos
-
[QUÍMICA] – Semana 09 – Funções inorgânicas – Parte 0210 Aulas|3 Testes
-
Semana 09 – Resolução 01 – Sais inorgânicos
-
Semana 09 – Resolução 02 – Óxidos
-
Semana 09 – Resolução 03 – Reações inorgânicas
-
Aula 37 – Sais inorgânicos
-
[PDF] Lista de apoio – Sais inorgânicos
-
Aula 38 – Nomenclatura de sais
-
Aula 39 – Reação de neutralização
-
Aula 40 – Solubilidade de sais
-
Aula 41 – Óxidos
-
Aula 42 – Reações inorgânicas
-
Semana 09 – Resolução 01 – Sais inorgânicos
-
[QUÍMICA] – Semana 10 – Grandezas e fórmulas químicas5 Aulas|2 Testes
-
[QUÍMICA] – Semana 11 – Estequiometria8 Aulas|3 Testes
-
[PDF] – lista de apoio – Estequiometria: Reações sucessivas, reagente limitante e em excesso
-
Aula 46 – Estequiometria básica
-
Aula 47 – Estequiometria – Pureza
-
Aula 48 – Estrquiometria – Rendimento
-
Aula 49 – Estequiometria reagentes limitante e em excesso
-
Aula 50 – Estequiometria – Reações sucessivas
-
[PDF]- lista de apoio- Estequiometria básica
-
[PDF] – lista de apoio – Estequiometria: Rendimento e pureza
-
[PDF] – lista de apoio – Estequiometria: Reações sucessivas, reagente limitante e em excesso
-
[QUÍMICA] – Semana 12 – Estequiometria – Exercícios1 Teste
-
[QUÍMICA] – Semana 13 – Teoria dos gases2 Aulas|2 Testes
-
[QUÍMICA] – Semana 14 – Classificação de dispersões e coeficiente de solubilidade2 Aulas|2 Testes
-
[QUÍMICA] – Semana 15 – Concentração de soluções5 Aulas|4 Testes
-
[QUÍMICA] – Semana 16 – SIMULADO GERAL1 Teste
-
[QUÍMICA] – Semana 17 – Concentração de soluções – Parte 027 Aulas|3 Testes
-
Aula 58 – Diluição de soluções
-
Aula 59 – Mistura de soluções: Solutos iguais
-
Aula 60 – Mistura de soluçõs: solutos diferentes que não reagem
-
Aula 61 – Mistura de soluções: solutos que ragem
-
Aula 62 – Titulação ácido-base
-
Semana 17 – Encontro virtual – Lista 35: Diluição de soluções
-
Semana 17 – Encontro virtual – Lista 36: Mistura de soluções
-
Aula 58 – Diluição de soluções
-
[QUÍMICA] – Semana 18 – Propriedades coligativas2 Aulas|2 Testes
-
[QUÍMICA] – Semana 19 – Termoquímica6 Aulas|4 Testes
-
[QUÍMICA] – Semana 20 – Cinética química5 Aulas|3 Testes
-
[QUÍMICA] – Semana 21 – Equilíbrio químico – Parte 013 Aulas|2 Testes
-
[QUÍMICA] – Semana 22 – Equilíbrio químico – Parte 024 Aulas|4 Testes
-
[QUÍMICA] – Semana 23 – Equilíbrio químico – Parte 035 Aulas|4 Testes
-
[QUÍMICA] – Semana 24 – Eletroquímica4 Aulas|3 Testes
-
[QUÍMICA] – Semana 25 – Introdução à química orgânica4 Aulas|2 Testes
-
[QUÍMICA] – Semana 26 – Nomenclatura de hidrocarbonetos4 Aulas|1 Teste
-
[QUÍMICA] – Semana 27 – Compostos oxigenados5 Aulas|1 Teste
-
[QUÍMICA] – Semana 28 – Compostos nitrogenados, halogenados e sulfurados6 Aulas|2 Testes
-
[QUÍMICA] – Semana 29 – Propriedades de compostos orgânicos5 Aulas|1 Teste
-
[QUÍMICA] – Semana 30 – Isomeria6 Aulas|2 Testes
-
[QUÍMICA] – Semana 31 – Reações orgânicas5 Aulas|4 Testes
-
[QUÍMICA] – Semana 32 – Outras reações e Polímeros2 Aulas|1 Teste
-
[REVISÃO – QUÍMICA] – Lista de revisão 01
-
[REVISÃO – QUÍMICA] – Lista de revisão 02
-
[REVISÃO – QUÍMICA] – Lista de revisão 03
-
[REVISÃO – QUÍMICA] – Lista de exercícios 04
Teste Summary
0 of 8 Perguntas completed
Perguntas:
Information
Você já concluiu o teste antes. Portanto, você não pode reiniciá-lo.
Teste is loading…
You must sign in or sign up to start the teste.
Você precisa primeiro terminar o seguinte:
Resultados
Resultados
0 de 8 Perguntas respondidas corretamente
Seu tempo:
Time has elapsed
Você atingiu 0 de 0 pontos, (0)
Earned Point(s): 0 of 0, (0)
0 Essay(s) Pending (Possible Point(s): 0)
Categories
- Química- Propriedades coligativas part 2 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- Atual
- Revisar
- Respondida
- Correto
- Incorreto
-
Pergunta 1 of 8
1. Question
(Unicamp) O etilenoglicol é uma substância muito solúvel em água, largamente utilizado como aditivo em radiadores de motores de automóveis, tanto em países frios como em países quentes. Considerando a função principal de um radiador, pode-se inferir corretamente que
CorretoIncorreto -
Pergunta 2 of 8
2. Question
(Enem) A escassez de água doce é um problema ambiental. A dessalinização da água do mar pode ser feita por um processo no qual o solvente é separado do soluto por uma membrana semipermeável. Neste caso observa-se a aplicação de pressão mecânica sobre a solução. Esse processo é conhecido como
CorretoIncorreto -
Pergunta 3 of 8
3. Question
(Uece) A descoberta do fenômeno da osmose foi atribuída a René Joachim Henri Dutrochet (1776 – 1847), físico e botânico francês, autor do termo “osmose”. Sua pesquisa teve fundamental importância para explicar o processo da respiração celular. A pressão osmótica utilizada para interromper a osmose de uma determinada solução de glicose (C6H12O6) contendo 10 g/L a 47 °C é, aproximadamente:
Dado: R = 0,082 atm.L.mol-1.K-1CorretoIncorreto -
Pergunta 4 of 8
4. Question
(Unisinos) As panelas de pressão são utensílios muito usados em cozinhas, existindo em vários tamanhos e modelos, sendo de alumínio, teflon ou aço inoxidável. Nelas, a água ferve em temperatura superior a 120°C. Isso ocorre porque a pressão dentro da panela é __________ do que a do ambiente, portanto a temperatura de ebulição da água__________ e, por isso, os alimentos cozinham mais __________, havendo __________ consumo de gás de cozinha.
No texto acima, as lacunas são corretamente preenchidas, respectivamente, porCorretoIncorreto -
Pergunta 5 of 8
5. Question
(Upf) Os efeitos coligativos se aplicam em soluções, por exemplo, a água pura à pressão de possui temperatura de fusão de e temperatura de ebulição de no entanto, ao adicionar-se um soluto não volátil a este sistema, este soluto modifica as propriedades do referido sistema.
Assim, analise as seguintes assertivas e julgue-as como verdadeiras (V) ou falsas (F) em relação ao acréscimo do soluto no sistema.
(__) a modificação coligativa na propriedade da diminuição da pressão de vapor se chama tonoscopia.
(__) os efeitos coligativos dependem somente do número de partículas do soluto dissolvidas.
(__) quanto maior for o número de partículas do soluto dissolvidas, menores serão os efeitos coligativos.
(__) a modificação coligativa na propriedade do aumento da temperatura de ebulição se chama ebulioscopia.
(__) a osmose não é um tipo de propriedade coligativa.
(__) ao acrescentar sal de cozinha numa água pura, o sistema vai congelar abaixo de 0ºC e sua temperatura de ebulição vai estar acima de 100ºC este efeito se chama crioscopia.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é:CorretoIncorreto -
Pergunta 6 of 8
6. Question
A figura a seguir mostra dois conjuntos com dois béqueres (A) e (B) com soluções aquosas de mesmo soluto não volátil, porém de concentrações diferentes. Os béqueres estão colocados em um recipiente fechado. Após algum tempo, o sistema atinge o equilíbrio (sistema final) e observa-se que o nível da solução contida no béquer (A) aumentou e o nível da solução contida no béquer (B) diminuiu.
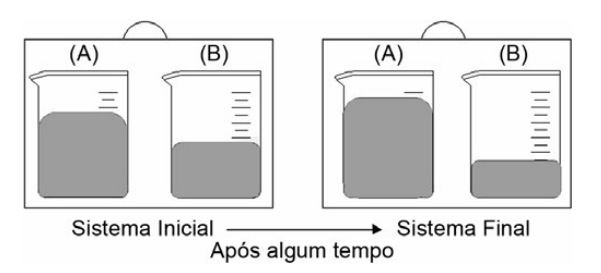
Com base na figura, considere as afirmativas a seguir.
I. No início, a pressão de vapor da água no béquer (B) é maior que a pressão de vapor da água no béquer (A).
II. Inicialmente a solução no béquer (B) está mais diluída que a solução no béquer (A).
III. A água é transferida, como vapor, da solução mais concentrada para a solução mais diluída.
IV. A pressão de vapor da água nos béqueres (A) e (B) é menor que a pressão de vapor da água pura.Estão corretas apenas as afirmativas:
CorretoIncorreto -
Pergunta 7 of 8
7. Question
(Famerp) A tabela apresenta as pressões de vapor, à mesma temperatura, de três substâncias polares I, II e III.
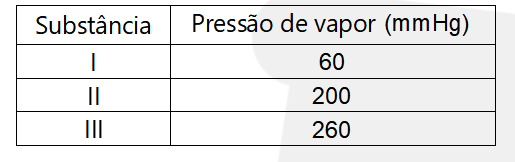
Considerando as informações fornecidas, pode-se afirmar que
CorretoIncorreto -
Pergunta 8 of 8
8. Question
(Pucpr) 100mg de nitrato de cálcio foram dissolvidos em 50cm3 de água, à temperatura de 50ºC Assinale a alternativa CORRETA, a qual traz a pressão a ser aplicada para impedir a osmose. Dado:Ma (g/mol): Ca- 40,N= 14, O= 16, R 0,082 atm.L/mol.K
CorretoIncorreto


Respostas