[Química] – Acompanhamento UFRR/UERR 2025
-
[Química] – Semana 0 – Introdução à química geral3 Aulas|1 Teste
-
[Química] – Semana 01 – Propriedades da matéria, substância, mistura e separação de misturas8 Aulas|2 Testes
-
[Química] – Semana 02 – Atomística – Parte 012 Aulas|1 Teste
-
[QUÍMICA] – Semana 03 – Atomística – Parte 023 Aulas|2 Testes
-
[QUÍMICA] – Semana 04 – Atomística – Parte 03 e Tabela periódica3 Aulas|2 Testes
-
[QUÍMICA] – Semana 05 – Ligações químicas5 Aulas|2 Testes
-
[QUÍMICA] – Semana 06 – Geometria molecular e interações intermoleculares5 Aulas|4 Testes
-
[QUÍMICA] – Semana 07 – Reação de oxirredução e balanceamento6 Aulas|1 Teste
-
[QUÍMICA] – Semana 08 – Funções inorgânicas – Parte 019 Aulas|2 Testes
-
Aula 41 – Óxidos
-
Aula 29 – Introdução às funções inorgânicas
-
Aula 31 – Nomenclatura de ácidos – Ácidos padrões
-
Aula 30 – Ácidos e suas classificações
-
Aula 32 – Nomenclatura de ácidos – Método por Nox
-
Aula 33 – Chuva ácida
-
Aula 34 – Bases de Arrhenius
-
Aula 35 – Nomenclatura de bases
-
Aula 36 – Indicadores ácido-base e escala de pH
-
Aula 41 – Óxidos
-
[QUÍMICA] – Semana 09 – Funções inorgânicas – Parte 0210 Aulas|3 Testes
-
Semana 09 – Resolução 01 – Sais inorgânicos
-
Semana 09 – Resolução 02 – Óxidos
-
Semana 09 – Resolução 03 – Reações inorgânicas
-
Aula 37 – Sais inorgânicos
-
[PDF] Lista de apoio – Sais inorgânicos
-
Aula 38 – Nomenclatura de sais
-
Aula 39 – Reação de neutralização
-
Aula 40 – Solubilidade de sais
-
Aula 41 – Óxidos
-
Aula 42 – Reações inorgânicas
-
Semana 09 – Resolução 01 – Sais inorgânicos
-
[QUÍMICA] – Semana 10 – Grandezas e fórmulas químicas5 Aulas|2 Testes
-
[QUÍMICA] – Semana 11 – Estequiometria8 Aulas|3 Testes
-
[PDF] – lista de apoio – Estequiometria: Reações sucessivas, reagente limitante e em excesso
-
Aula 46 – Estequiometria básica
-
Aula 47 – Estequiometria – Pureza
-
Aula 48 – Estrquiometria – Rendimento
-
Aula 49 – Estequiometria reagentes limitante e em excesso
-
Aula 50 – Estequiometria – Reações sucessivas
-
[PDF]- lista de apoio- Estequiometria básica
-
[PDF] – lista de apoio – Estequiometria: Rendimento e pureza
-
[PDF] – lista de apoio – Estequiometria: Reações sucessivas, reagente limitante e em excesso
-
[QUÍMICA] – Semana 12 – Estequiometria – Exercícios1 Teste
-
[QUÍMICA] – Semana 13 – Teoria dos gases2 Aulas|2 Testes
-
[QUÍMICA] – Semana 14 – Classificação de dispersões e coeficiente de solubilidade2 Aulas|2 Testes
-
[QUÍMICA] – Semana 15 – Concentração de soluções5 Aulas|4 Testes
-
[QUÍMICA] – Semana 16 – SIMULADO GERAL1 Teste
-
[QUÍMICA] – Semana 17 – Concentração de soluções – Parte 027 Aulas|3 Testes
-
Aula 58 – Diluição de soluções
-
Aula 59 – Mistura de soluções: Solutos iguais
-
Aula 60 – Mistura de soluçõs: solutos diferentes que não reagem
-
Aula 61 – Mistura de soluções: solutos que ragem
-
Aula 62 – Titulação ácido-base
-
Semana 17 – Encontro virtual – Lista 35: Diluição de soluções
-
Semana 17 – Encontro virtual – Lista 36: Mistura de soluções
-
Aula 58 – Diluição de soluções
-
[QUÍMICA] – Semana 18 – Propriedades coligativas2 Aulas|2 Testes
-
[QUÍMICA] – Semana 19 – Termoquímica6 Aulas|4 Testes
-
[QUÍMICA] – Semana 20 – Cinética química5 Aulas|3 Testes
-
[QUÍMICA] – Semana 21 – Equilíbrio químico – Parte 013 Aulas|2 Testes
-
[QUÍMICA] – Semana 22 – Equilíbrio químico – Parte 024 Aulas|4 Testes
-
[QUÍMICA] – Semana 23 – Equilíbrio químico – Parte 035 Aulas|4 Testes
-
[QUÍMICA] – Semana 24 – Eletroquímica4 Aulas|3 Testes
-
[QUÍMICA] – Semana 25 – Introdução à química orgânica4 Aulas|2 Testes
-
[QUÍMICA] – Semana 26 – Nomenclatura de hidrocarbonetos4 Aulas|1 Teste
-
[QUÍMICA] – Semana 27 – Compostos oxigenados5 Aulas|1 Teste
-
[QUÍMICA] – Semana 28 – Compostos nitrogenados, halogenados e sulfurados6 Aulas|2 Testes
-
[QUÍMICA] – Semana 29 – Propriedades de compostos orgânicos5 Aulas|1 Teste
-
[QUÍMICA] – Semana 30 – Isomeria6 Aulas|2 Testes
-
[QUÍMICA] – Semana 31 – Reações orgânicas5 Aulas|4 Testes
-
[QUÍMICA] – Semana 32 – Outras reações e Polímeros2 Aulas|1 Teste
-
[REVISÃO – QUÍMICA] – Lista de revisão 01
-
[REVISÃO – QUÍMICA] – Lista de revisão 02
-
[REVISÃO – QUÍMICA] – Lista de revisão 03
-
[REVISÃO – QUÍMICA] – Lista de exercícios 04
Teste Summary
0 of 10 Perguntas completed
Perguntas:
Information
Você já concluiu o teste antes. Portanto, você não pode reiniciá-lo.
Teste is loading…
You must sign in or sign up to start the teste.
Você precisa primeiro terminar o seguinte:
Resultados
Resultados
0 de 10 Perguntas respondidas corretamente
Seu tempo:
Time has elapsed
Você atingiu 0 de 0 pontos, (0)
Earned Point(s): 0 of 0, (0)
0 Essay(s) Pending (Possible Point(s): 0)
| Pontos Médios |
|
| Sua pontuação |
|
Categories
- Química- isomeria plana 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Atual
- Revisar
- Respondida
- Correto
- Incorreto
-
Pergunta 1 of 10
1. Question
Qual o tipo de isomeria plana que ocorre em cada par ?
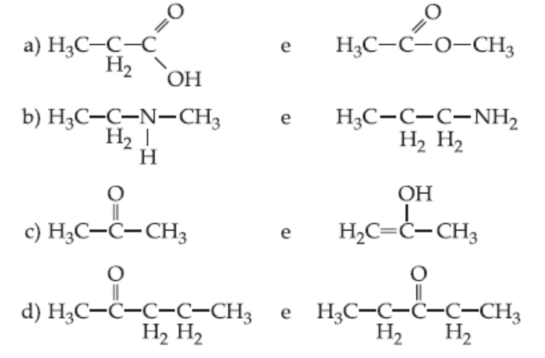 CorretoIncorreto
CorretoIncorreto -
Pergunta 2 of 10
2. Question
(ITA-SP) Considere as afirmações:
I. Propanal é um isômero da propanona.
II. Etil-metil-éter é um isômero do propan-2-ol.
III. Propan-1-ol é um isômero do propan-2-ol.
IV. Propilamina é um isômero da trimetilamina.Estão corretas:
CorretoIncorreto -
Pergunta 3 of 10
3. Question
Analise os compostos a seguir:
1) CH3COCH3
2) CH3COOCH3
3) CH3CH2CHO
4) CH3CH2COOH
5) CH3CH2CH2OH
6) CH3OCH2CH3São isômeros os pares:
CorretoIncorreto -
Pergunta 4 of 10
4. Question
(Upf) A isomeria surgiu a partir de uma coincidência observada na avaliação de dois trabalhos científicos diferentes enviados a J. J. Berzelius, em 1830. Os dois sobre a descoberta de um novo composto, ambos de fórmula AgCNO, mas de propriedades distintas. Após investigações mais detalhadas, Berzelius confirmou a veracidade das duas comunicações científicas, e, pela primeira vez, observou a possibilidade de existir diversos compostos, de propriedades físicas e químicas diferentes, com a mesma fórmula molecular.
A isomeria plana estuda as diferentes formas de se estruturar as cadeias carbônicas. Relacione a coluna da esquerda com a da direita e marque a alternativa que apresenta a relação correta. CorretoIncorreto
CorretoIncorreto -
Pergunta 5 of 10
5. Question
(Fatec) O estresse está se tornando um problema cada vez maior no mundo do trabalho. Situações e estímulos do ambiente de trabalho que pressionam o trabalhador, em diferentes contextos, provocam a produção de diversos hormônios em seu organismo como, por exemplo, o cortisol. O cortisol é responsável pela regulação de diversos processos metabólicos humanos. Sua forma sintética, a hidrocortisona, é usada no combate a inflamações e alergias.
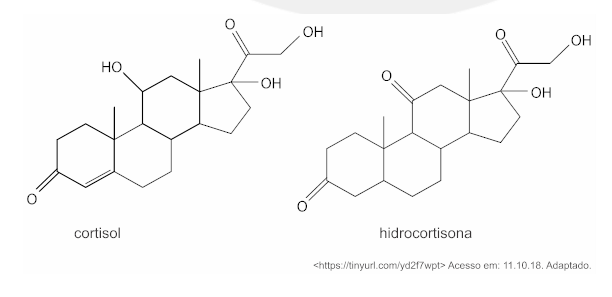
Em química, isomeria é um fenômeno que ocorre quando duas ou mais moléculas apresentam a mesma fórmula molecular.
Observando as fórmulas estruturais do cortisol e da hidrocortisona, pode-se concluir corretamente que estes compostos
CorretoIncorreto -
Pergunta 6 of 10
6. Question
(Fameca-SP) Associe corretamente a coluna I com a coluna II.
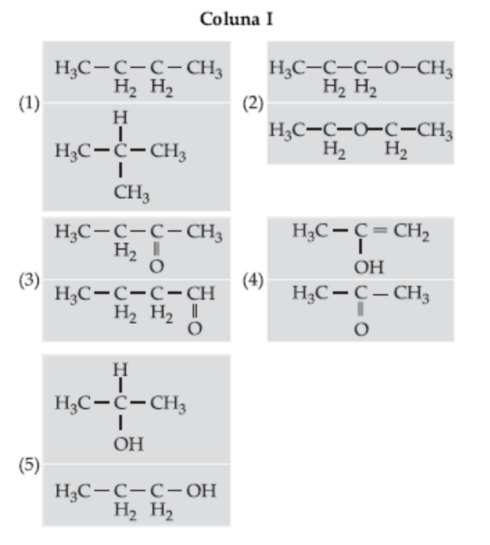
Coluna II
(__) Isomeria de posição
(__) Isomeria de cadeia
(__) Metameria
(__) Tautomeria
(__) Isomeria funcionalCorretoIncorreto -
Pergunta 7 of 10
7. Question
(Uem) Dadas as fórmulas moleculares a seguir, assinale o que for correto.
I. C7H16
II. C4H10O01) O composto I pode ser o 2,3-dimetilpentano.
02) O composto II pode ser o ácido butanoico.
04) O composto II pode ser o butan-2-ol, um álcool secundário.
08) O composto II pode ser a butan-2-ona, que é isômero de função do butan-2-ol.
16) O composto I pode ser um hidrocarboneto insaturado solúvel em água.CorretoIncorreto -
Pergunta 8 of 10
8. Question
08. (Uem) Assinale a(s) alternativa(s) que apresenta(m) correta descrição de cadeias carbônicas e suas isomerias.
01) A propanona e o propanal não apresentam heteroátomo e são isômeros de função.
02) O 3,4-dietil-hexano é isômero de posição do 3-etil-heptano.
04) Os compostos 1-penteno, ciclopentano e metilciclobutano são isômeros de cadeia.
08) Os dois isômeros ópticos do ácido-2-hidróxi-propanoico apresentam temperaturas de fusão diferentes.
16) O benzeno apresenta cadeia saturadaCorretoIncorreto -
Pergunta 9 of 10
9. Question
(Pucpr Medicina) Leia o excerto a seguir
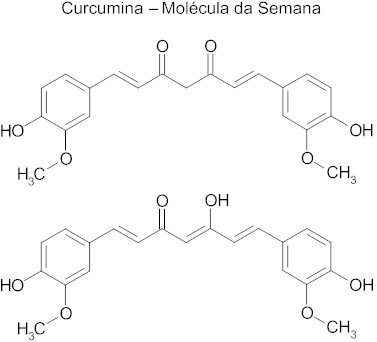
A curcumina (C21H20O6) é o principal curcuminoide presente no Aēafrćo-da-Ķndia.
[…]
No estado puro, a curcumina é um pó cristalino amarelo-alaranjado vivo, ligeiramente sensķvel ą luz. Tem uma massa molar de 368,38 g/mol e um ponto de fusão de 183ºC. É insolúvel em água, porém é solúvel em etanol (10mg/mL)
[…]
Uma dose diįria de 2 g de extrato de Cśrcuma se mostrou eficaz no alívio de dores, mostrando-se também ser equivalente ao ibuprofeno para o alívio das dores causadas por osteoartrites. Algumas das capsulas comerciais que contém curcumina também apresentam uma ligeira dose de piperina, que auxilia a absorção da curcumina na circulação sanguínea. Porém também está provado que a curcumina agrava problemas de cálculos biliares.
[…]Note e adote: número de Avogadro: Na = 6,02.1023 moléculas/mol
De acordo com o enunciado, é possķvel afirmar que
CorretoIncorreto -
Pergunta 10 of 10
10. Question
(Uem-pas) Isoleucina, Leucina e Valina são aminoácidos essenciais, ou seja, aminoácidos que não são produzidos pelo nosso organismo. Assim, nós precisamos ingeri-los por meio de alimentação ou por suplemento alimentar. Com base na estrutura química dos aminoácidos, assinale o que for correto.
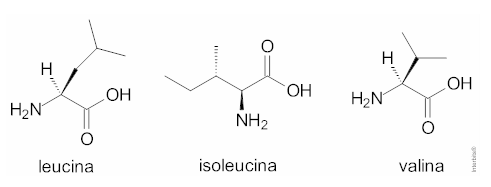
01) A carbonila é um grupo funcional presente nas estruturas dos aminoácidos.
02) A leucina possui um substituinte isobutil e a valina um substituinte isopropil.
04) Cada um dos aminoácidos citados possui em sua estrutura um centro quiral.
08) A molécula da isoleucina pode existir sob a forma de dois isômeros ópticos.
16) A leucina e a isoleucina são isômeros constitucionais de posição.CorretoIncorreto


Respostas