[Química] – Acompanhamento UFRR/UERR 2025
-
[Química] – Semana 0 – Introdução à química geral3 Aulas|1 Teste
-
[Química] – Semana 01 – Propriedades da matéria, substância, mistura e separação de misturas8 Aulas|2 Testes
-
[Química] – Semana 02 – Atomística – Parte 012 Aulas|1 Teste
-
[QUÍMICA] – Semana 03 – Atomística – Parte 023 Aulas|2 Testes
-
[QUÍMICA] – Semana 04 – Atomística – Parte 03 e Tabela periódica3 Aulas|2 Testes
-
[QUÍMICA] – Semana 05 – Ligações químicas5 Aulas|2 Testes
-
[QUÍMICA] – Semana 06 – Geometria molecular e interações intermoleculares5 Aulas|4 Testes
-
[QUÍMICA] – Semana 07 – Reação de oxirredução e balanceamento6 Aulas|1 Teste
-
[QUÍMICA] – Semana 08 – Funções inorgânicas – Parte 019 Aulas|2 Testes
-
Aula 41 – Óxidos
-
Aula 29 – Introdução às funções inorgânicas
-
Aula 31 – Nomenclatura de ácidos – Ácidos padrões
-
Aula 30 – Ácidos e suas classificações
-
Aula 32 – Nomenclatura de ácidos – Método por Nox
-
Aula 33 – Chuva ácida
-
Aula 34 – Bases de Arrhenius
-
Aula 35 – Nomenclatura de bases
-
Aula 36 – Indicadores ácido-base e escala de pH
-
Aula 41 – Óxidos
-
[QUÍMICA] – Semana 09 – Funções inorgânicas – Parte 0210 Aulas|3 Testes
-
Semana 09 – Resolução 01 – Sais inorgânicos
-
Semana 09 – Resolução 02 – Óxidos
-
Semana 09 – Resolução 03 – Reações inorgânicas
-
Aula 37 – Sais inorgânicos
-
[PDF] Lista de apoio – Sais inorgânicos
-
Aula 38 – Nomenclatura de sais
-
Aula 39 – Reação de neutralização
-
Aula 40 – Solubilidade de sais
-
Aula 41 – Óxidos
-
Aula 42 – Reações inorgânicas
-
Semana 09 – Resolução 01 – Sais inorgânicos
-
[QUÍMICA] – Semana 10 – Grandezas e fórmulas químicas5 Aulas|2 Testes
-
[QUÍMICA] – Semana 11 – Estequiometria8 Aulas|3 Testes
-
[PDF] – lista de apoio – Estequiometria: Reações sucessivas, reagente limitante e em excesso
-
Aula 46 – Estequiometria básica
-
Aula 47 – Estequiometria – Pureza
-
Aula 48 – Estrquiometria – Rendimento
-
Aula 49 – Estequiometria reagentes limitante e em excesso
-
Aula 50 – Estequiometria – Reações sucessivas
-
[PDF]- lista de apoio- Estequiometria básica
-
[PDF] – lista de apoio – Estequiometria: Rendimento e pureza
-
[PDF] – lista de apoio – Estequiometria: Reações sucessivas, reagente limitante e em excesso
-
[QUÍMICA] – Semana 12 – Estequiometria – Exercícios1 Teste
-
[QUÍMICA] – Semana 13 – Teoria dos gases2 Aulas|2 Testes
-
[QUÍMICA] – Semana 14 – Classificação de dispersões e coeficiente de solubilidade2 Aulas|2 Testes
-
[QUÍMICA] – Semana 15 – Concentração de soluções5 Aulas|4 Testes
-
[QUÍMICA] – Semana 16 – SIMULADO GERAL1 Teste
-
[QUÍMICA] – Semana 17 – Concentração de soluções – Parte 027 Aulas|3 Testes
-
Aula 58 – Diluição de soluções
-
Aula 59 – Mistura de soluções: Solutos iguais
-
Aula 60 – Mistura de soluçõs: solutos diferentes que não reagem
-
Aula 61 – Mistura de soluções: solutos que ragem
-
Aula 62 – Titulação ácido-base
-
Semana 17 – Encontro virtual – Lista 35: Diluição de soluções
-
Semana 17 – Encontro virtual – Lista 36: Mistura de soluções
-
Aula 58 – Diluição de soluções
-
[QUÍMICA] – Semana 18 – Propriedades coligativas2 Aulas|2 Testes
-
[QUÍMICA] – Semana 19 – Termoquímica6 Aulas|4 Testes
-
[QUÍMICA] – Semana 20 – Cinética química5 Aulas|3 Testes
-
[QUÍMICA] – Semana 21 – Equilíbrio químico – Parte 013 Aulas|2 Testes
-
[QUÍMICA] – Semana 22 – Equilíbrio químico – Parte 024 Aulas|4 Testes
-
[QUÍMICA] – Semana 23 – Equilíbrio químico – Parte 035 Aulas|4 Testes
-
[QUÍMICA] – Semana 24 – Eletroquímica4 Aulas|3 Testes
-
[QUÍMICA] – Semana 25 – Introdução à química orgânica4 Aulas|2 Testes
-
[QUÍMICA] – Semana 26 – Nomenclatura de hidrocarbonetos4 Aulas|1 Teste
-
[QUÍMICA] – Semana 27 – Compostos oxigenados5 Aulas|1 Teste
-
[QUÍMICA] – Semana 28 – Compostos nitrogenados, halogenados e sulfurados6 Aulas|2 Testes
-
[QUÍMICA] – Semana 29 – Propriedades de compostos orgânicos5 Aulas|1 Teste
-
[QUÍMICA] – Semana 30 – Isomeria6 Aulas|2 Testes
-
[QUÍMICA] – Semana 31 – Reações orgânicas5 Aulas|4 Testes
-
[QUÍMICA] – Semana 32 – Outras reações e Polímeros2 Aulas|1 Teste
-
[REVISÃO – QUÍMICA] – Lista de revisão 01
-
[REVISÃO – QUÍMICA] – Lista de revisão 02
-
[REVISÃO – QUÍMICA] – Lista de revisão 03
-
[REVISÃO – QUÍMICA] – Lista de exercícios 04
Teste Summary
0 of 13 Perguntas completed
Perguntas:
Information
Você já concluiu o teste antes. Portanto, você não pode reiniciá-lo.
Teste is loading…
You must sign in or sign up to start the teste.
Você precisa primeiro terminar o seguinte:
Resultados
Resultados
0 de 13 Perguntas respondidas corretamente
Seu tempo:
Time has elapsed
Você atingiu 0 de 0 pontos, (0)
Earned Point(s): 0 of 0, (0)
0 Essay(s) Pending (Possible Point(s): 0)
| Pontos Médios |
|
| Sua pontuação |
|
Categories
- Química- Introdução ao equilíbrio químico 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- Atual
- Revisar
- Respondida
- Correto
- Incorreto
-
Pergunta 1 of 13
1. Question
(UFRGS-RS) O gráfico a seguir representa a evolução de um sistema em que uma reação reversível ocorre até atingir o equilíbrio.
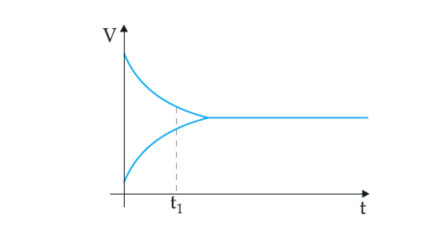
Sobre o ponto t1, neste gráfico, pode-se afirmar que indica:
CorretoIncorreto -
Pergunta 2 of 13
2. Question
(UFRGS-RS) Uma reação química atinge o equilíbrio químico quando:
CorretoIncorreto -
Pergunta 3 of 13
3. Question
(CEFET–PR) Com relação ao equilíbrio químico, afirma-se:
I. O equilíbrio químico só pode ser atingido em sistema fechado (onde não há troca de matéria com o meio ambiente).
II. Num equilíbrio químico, as propriedades macroscópicas do sistema (concentração, densidade, massa e cor) permanecem constantes.
III. Num equilíbrio químico, as propriedades microscópicas do sistema (colisões entre as moléculas, formação de complexos ativados e transformações de umas substâncias em outras) permanecem em evolução, pois o equilíbrio é dinâmico.É (são) correta(s) a(s) afirmação(ões):
CorretoIncorreto -
Pergunta 4 of 13
4. Question
(VUNESP-SP) Estudou-se a cinética da reação:
S(s) + O2(g) → SO2(g)
realizada a partir de enxofre e oxigênio em um sistema fechado. Assim, as curvas I, II e III do gráfico abaixo representam as variações das concentrações dos componentes com o tempo, desde o momento da mistura até o sistema atingir o equilíbrio.
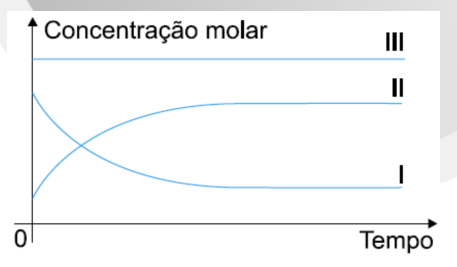
As variações das concentrações de S, de O2 e de SO2 são representadas, respectivamente, pelas curvas:
CorretoIncorreto -
Pergunta 5 of 13
5. Question
(UEL-PR) Para que se possa determinar a constante de um equilíbrio químico, é necessário que:
CorretoIncorreto -
Pergunta 6 of 13
6. Question
(PUC-RS) Dada a expressão da constante de equilíbrio em termos de concentração de produtos e reagentes a equação química que pode ser representada por essa expressão é:
 CorretoIncorreto
CorretoIncorreto -
Pergunta 7 of 13
7. Question
(Mackenzie 2018) Considerando-se o equilíbrio químico equacionado por
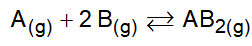 sob temperatura de 300K a alternativa que mostra a expressão correta da constante de equilíbrio em termos de concentração em mols por litro éCorretoIncorreto
sob temperatura de 300K a alternativa que mostra a expressão correta da constante de equilíbrio em termos de concentração em mols por litro éCorretoIncorreto -
Pergunta 8 of 13
8. Question
(UEL-PR) Para o equilíbrio
2 NbCℓ4(g) ⇌ NbCℓ3(g) + NbCℓ5(g)
obteve-se, a 1,0 · 103 kelvins, as pressões parciais:
NbCℓ4 = 1,0 · 10-2 atm
NbCℓ3 = 5,0 · 10-3 atm
NbCℓ5 = 1,0 · 10-4 atmCom esses dados calcula-se o valor da constante, Kp, do equilíbrio acima. Seu valor numérico é:
CorretoIncorreto -
Pergunta 9 of 13
9. Question
(UEL-PR) Para o equilíbrio químico N2(g) + O2(g) ⇌ 2NO(g) foram encontrados os seguintes valores para a constante Kc, às temperaturas indicadas:
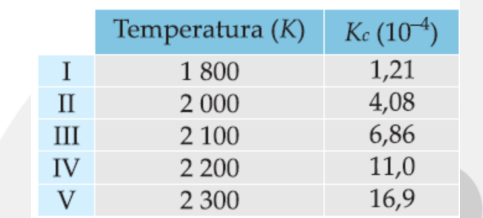
Há maior concentração molar do NO(g) em
CorretoIncorreto -
Pergunta 10 of 13
10. Question
(FUVEST-SP) A alta temperatura, N2 reage com O2 produzindo NO, que é um poluente atmosférico:
N2(g) + O2(g) ⇌ 2 NO(g)
À temperatura de 2000 kelvins, a constante do equilíbrio acima é igual a 4,0 · 10-4. Nesta temperatura, se as concentrações de equilíbrio de N2 e O2 forem, respectivamente, 4,0 · 10-3 e 1,0 · 10-3 mol/L, qual será a de NO?
CorretoIncorreto -
Pergunta 11 of 13
11. Question
(UFV-MG) Considere uma reação hipotética:
A(g) + B(g) ⇌ C(g) + D(g)
O gráfico da variação da concentração dos reagentes e produtos, em função do tempo, a uma dada temperatura, é mostrado abaixo.
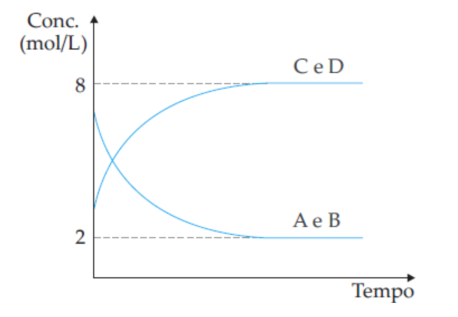
A constante de equilíbrio para a reação é:
CorretoIncorreto -
Pergunta 12 of 13
12. Question
Considerando a reação PCℓ3(g) + Cℓ2(g) ⇌ PCℓ5(g), a constante de equilíbrio em termos de concentração (Kc), vale 1,8 à temperatura T. Em um recipiente, à temperatura T, temos uma mistura dos três gases com as seguintes concentrações:
[PCℓ3(g)] = 0,20 mol/L
[Cℓ2] = 0,25 mol/L
[PCℓ5(g)] = 0,50 mol/LPodemos concluir que:
CorretoIncorreto -
Pergunta 13 of 13
13. Question
(U.Caxias do Sul-RS) Em um recipiente fechado sob pressão de 6 atm, é mantido o sistema gasoso:
2 SO2(g) + O2(g) ⇌ 2 SO3(g)
Constituído por 0,40 mols de dióxido de enxofre 1,60 mols de oxigênio e 2,00 mols de trióxido de enxofre. O valor da constante de equilíbrio do sistema, em termos de pressões parciais, é aproximadamente:
CorretoIncorreto


Respostas