[Química] – Acompanhamento UFRR/UERR 2025
-
[Química] – Semana 0 – Introdução à química geral3 Aulas|1 Teste
-
[Química] – Semana 01 – Propriedades da matéria, substância, mistura e separação de misturas8 Aulas|2 Testes
-
[Química] – Semana 02 – Atomística – Parte 012 Aulas|1 Teste
-
[QUÍMICA] – Semana 03 – Atomística – Parte 023 Aulas|2 Testes
-
[QUÍMICA] – Semana 04 – Atomística – Parte 03 e Tabela periódica3 Aulas|2 Testes
-
[QUÍMICA] – Semana 05 – Ligações químicas5 Aulas|2 Testes
-
[QUÍMICA] – Semana 06 – Geometria molecular e interações intermoleculares5 Aulas|4 Testes
-
[QUÍMICA] – Semana 07 – Reação de oxirredução e balanceamento6 Aulas|1 Teste
-
[QUÍMICA] – Semana 08 – Funções inorgânicas – Parte 019 Aulas|2 Testes
-
Aula 41 – Óxidos
-
Aula 29 – Introdução às funções inorgânicas
-
Aula 31 – Nomenclatura de ácidos – Ácidos padrões
-
Aula 30 – Ácidos e suas classificações
-
Aula 32 – Nomenclatura de ácidos – Método por Nox
-
Aula 33 – Chuva ácida
-
Aula 34 – Bases de Arrhenius
-
Aula 35 – Nomenclatura de bases
-
Aula 36 – Indicadores ácido-base e escala de pH
-
Aula 41 – Óxidos
-
[QUÍMICA] – Semana 09 – Funções inorgânicas – Parte 0210 Aulas|3 Testes
-
Semana 09 – Resolução 01 – Sais inorgânicos
-
Semana 09 – Resolução 02 – Óxidos
-
Semana 09 – Resolução 03 – Reações inorgânicas
-
Aula 37 – Sais inorgânicos
-
[PDF] Lista de apoio – Sais inorgânicos
-
Aula 38 – Nomenclatura de sais
-
Aula 39 – Reação de neutralização
-
Aula 40 – Solubilidade de sais
-
Aula 41 – Óxidos
-
Aula 42 – Reações inorgânicas
-
Semana 09 – Resolução 01 – Sais inorgânicos
-
[QUÍMICA] – Semana 10 – Grandezas e fórmulas químicas5 Aulas|2 Testes
-
[QUÍMICA] – Semana 11 – Estequiometria8 Aulas|3 Testes
-
[PDF] – lista de apoio – Estequiometria: Reações sucessivas, reagente limitante e em excesso
-
Aula 46 – Estequiometria básica
-
Aula 47 – Estequiometria – Pureza
-
Aula 48 – Estrquiometria – Rendimento
-
Aula 49 – Estequiometria reagentes limitante e em excesso
-
Aula 50 – Estequiometria – Reações sucessivas
-
[PDF]- lista de apoio- Estequiometria básica
-
[PDF] – lista de apoio – Estequiometria: Rendimento e pureza
-
[PDF] – lista de apoio – Estequiometria: Reações sucessivas, reagente limitante e em excesso
-
[QUÍMICA] – Semana 12 – Estequiometria – Exercícios1 Teste
-
[QUÍMICA] – Semana 13 – Teoria dos gases2 Aulas|2 Testes
-
[QUÍMICA] – Semana 14 – Classificação de dispersões e coeficiente de solubilidade2 Aulas|2 Testes
-
[QUÍMICA] – Semana 15 – Concentração de soluções5 Aulas|4 Testes
-
[QUÍMICA] – Semana 16 – SIMULADO GERAL1 Teste
-
[QUÍMICA] – Semana 17 – Concentração de soluções – Parte 027 Aulas|3 Testes
-
Aula 58 – Diluição de soluções
-
Aula 59 – Mistura de soluções: Solutos iguais
-
Aula 60 – Mistura de soluçõs: solutos diferentes que não reagem
-
Aula 61 – Mistura de soluções: solutos que ragem
-
Aula 62 – Titulação ácido-base
-
Semana 17 – Encontro virtual – Lista 35: Diluição de soluções
-
Semana 17 – Encontro virtual – Lista 36: Mistura de soluções
-
Aula 58 – Diluição de soluções
-
[QUÍMICA] – Semana 18 – Propriedades coligativas2 Aulas|2 Testes
-
[QUÍMICA] – Semana 19 – Termoquímica6 Aulas|4 Testes
-
[QUÍMICA] – Semana 20 – Cinética química5 Aulas|3 Testes
-
[QUÍMICA] – Semana 21 – Equilíbrio químico – Parte 013 Aulas|2 Testes
-
[QUÍMICA] – Semana 22 – Equilíbrio químico – Parte 024 Aulas|4 Testes
-
[QUÍMICA] – Semana 23 – Equilíbrio químico – Parte 035 Aulas|4 Testes
-
[QUÍMICA] – Semana 24 – Eletroquímica4 Aulas|3 Testes
-
[QUÍMICA] – Semana 25 – Introdução à química orgânica4 Aulas|2 Testes
-
[QUÍMICA] – Semana 26 – Nomenclatura de hidrocarbonetos4 Aulas|1 Teste
-
[QUÍMICA] – Semana 27 – Compostos oxigenados5 Aulas|1 Teste
-
[QUÍMICA] – Semana 28 – Compostos nitrogenados, halogenados e sulfurados6 Aulas|2 Testes
-
[QUÍMICA] – Semana 29 – Propriedades de compostos orgânicos5 Aulas|1 Teste
-
[QUÍMICA] – Semana 30 – Isomeria6 Aulas|2 Testes
-
[QUÍMICA] – Semana 31 – Reações orgânicas5 Aulas|4 Testes
-
[QUÍMICA] – Semana 32 – Outras reações e Polímeros2 Aulas|1 Teste
-
[REVISÃO – QUÍMICA] – Lista de revisão 01
-
[REVISÃO – QUÍMICA] – Lista de revisão 02
-
[REVISÃO – QUÍMICA] – Lista de revisão 03
-
[REVISÃO – QUÍMICA] – Lista de exercícios 04
Teste Summary
0 of 10 Perguntas completed
Perguntas:
Information
Você já concluiu o teste antes. Portanto, você não pode reiniciá-lo.
Teste is loading…
You must sign in or sign up to start the teste.
Você precisa primeiro terminar o seguinte:
Resultados
Resultados
0 de 10 Perguntas respondidas corretamente
Seu tempo:
Time has elapsed
Você atingiu 0 de 0 pontos, (0)
Earned Point(s): 0 of 0, (0)
0 Essay(s) Pending (Possible Point(s): 0)
| Pontos Médios |
|
| Sua pontuação |
|
Categories
- Química- Propriedades coligativas part 1 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Atual
- Revisar
- Respondida
- Correto
- Incorreto
-
Pergunta 1 of 10
1. Question
(UFMA-MA) Com referência aos pontos assinalados no diagrama de fases, pode-se afirmar que:
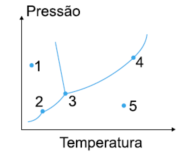 CorretoIncorreto
CorretoIncorreto -
Pergunta 2 of 10
2. Question
(Unimontes-MG) A figura a seguir relaciona o efeito de um soluto não volátil sobre o diagrama de fase da água.
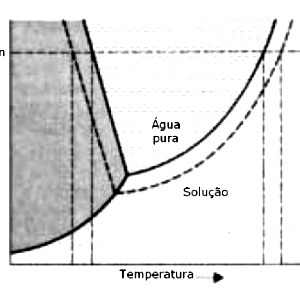
A adição de um soluto não volátil à água pura provoca os seguintes efeitos, EXCETO
CorretoIncorreto -
Pergunta 3 of 10
3. Question
(Unesp) Entre 6 e 23 de fevereiro aconteceram os Jogos Olímpicos de Inverno de 2014. Dentre as diversas modalidades esportivas, o curling é um jogo disputado entre duas equipes sobre uma pista de gelo, seu objetivo consiste em fazer com que uma pedra de granito em forma de disco fique o mais próximo de um alvo circular. Vassouras são utilizadas pelas equipes para varrer a superfície do gelo na frente da pedra, de modo a influenciar tanto sua direção como sua velocidade. A intensidade da fricção e a pressão aplicada pelos atletas durante o processo de varredura podem fazer com que a velocidade da pedra mude em até 20% devido à formação de uma película de água líquida entre a pedra e a pista.
O gráfico apresenta o diagrama de fases da água.
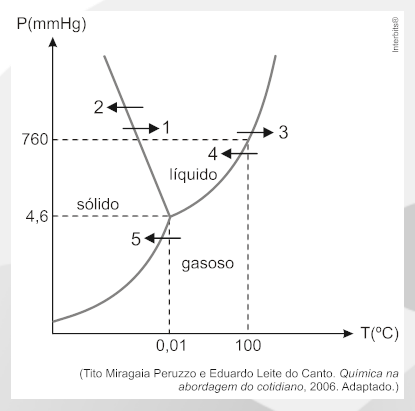 CorretoIncorreto
CorretoIncorreto -
Pergunta 4 of 10
4. Question
(UNISA-SP) A pressão de vapor de um líquido puro molecular depende:
CorretoIncorreto -
Pergunta 5 of 10
5. Question
A uma dada temperatura, possui a menor pressão de vapor a solução aquosa:
CorretoIncorreto -
Pergunta 6 of 10
6. Question
(PUC-SP) Temos três soluções:
A. sacarose 0,6 mol/L de H2O
B. KCℓ 0,5 mol/L de H2O
C. Na2SO4 0,5 mol/L de H2OA relação entre as temperaturas de início de ebulição é:
CorretoIncorreto -
Pergunta 7 of 10
7. Question
(VUNESP-SP) Considere cinco soluções aquosas diferentes, todas de concentração 0,1 mol/L, de glicose (C6H12O6), e de quatro eletrólitos fortes, NaCℓ, KCℓ, K2SO4 e ZnSO4, respectivamente. A solução que apresenta a maior temperatura de ebulição é:
CorretoIncorreto -
Pergunta 8 of 10
8. Question
(PUCCAMP-SP) Considere o texto abaixo.
“Se as células vermelhas do sangue forem removidas para um béquer contendo água destilada, haverá passagem da água para …..I…….das células.
Se as células forem colocadas numa solução salina concentrada, haverá migração da água para ….II…..das células com o ……III….. das mesmas.
As soluções projetadas para injeções endovenosas devem ter …..IV…..próximas às das soluções contidas nas células.”
Para completá-lo corretamente, I, II, III e IV devem ser substituídos, respectivamente, por:CorretoIncorreto -
Pergunta 9 of 10
9. Question
(Ueg) As propriedades físicas dos líquidos podem ser comparadas a partir de um gráfico de pressão de vapor em função da temperatura, como mostrado no gráfico hipotético a seguir para as substâncias A, B, C e D
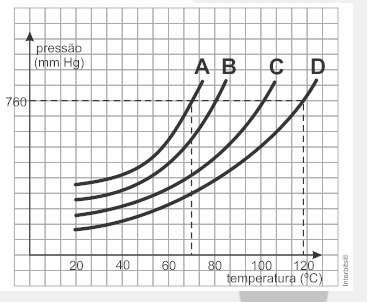
Segundo o gráfico, o líquido mais volátil será a substância
CorretoIncorreto -
Pergunta 10 of 10
10. Question
(Usf) A adição de determinados solutos em meio aquoso muda algumas das propriedades físicas do solvente. Considere três recipientes que contenham de soluções aquosas com concentração molar igual a das seguintes substâncias:
I. Sacarose – C12H12O11
II. Cloreto de sódio – NaCl
III. Nitrato de cálcio – Ca(NO3)2
Ao medir algumas das propriedades físicas dessas soluções, foi observado queCorretoIncorreto


Respostas